致审查申请人的告知书
发布时间:2020-09-15
致审查申请人的告知书
生物医学研究(科研)项目及医疗新技术/新项目经本院伦理委员会批准后,如有修正、增补材料、发生SAE和方案违背、提前终止、结题等,请按照以下要求进行提交。
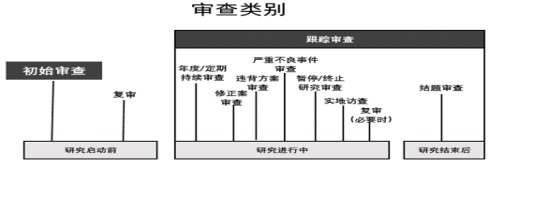
一、 复审
初次审查 / 跟踪审查 / 严重不良事件(SAE)等审查的审查意见为“修改后批准”或“修改后再审”的,需提交《复审审查申请表》,同时提交修改后的材料和 受理文件及签收单。(如果研究者 / 项目负责人对伦理审查的否定性决定持不同意见的,也可以提交复审申请);
二、 年度/定期持续审查
自项目通过伦理审查批准之日起开始算,按照伦理审查批件/意见规定的持续审查频率(12个月/6个月),提前4周递交《年度/定期持续审查汇报表》和受理文件及签收单;当出现任何可能显著影响研究进行或增加受试者危险的情况时,应以《研究进展报告》的方式,及时报告伦理委员会。如果伦理审查批件有效期到期,需要申请延长批件有效期,应通过《研究进展报告》申请;
三、 修正案审查
研究方案、知情同意书、招募材料等需要修改的,请提交《修正案审查申请表》、方案修改说明和受理文件及签收单;
四、 发生严重违背方案
在本中心发生的严重违背/偏离方案和持续违背方案,对受试者/研究结果造成影响的,应该在发生后1月内上报,填写《方案偏离/违背报告表》和受理文件及签收单;
五、 发生严重不良事件(SAE)
在本中心发生的严重不良事件和非预期不良事件,要求在获知后24小时内上报伦理委员会,填写本中心专用的《严重不良事件和非预期不良事件报告表》和受理文件及签收单;
六、 暂停/终止研究
如果该项目提前终止或暂停,需提交《暂停/终止研究报告表》和受理文件及签收单;
七、 研究完成
研究结束时需提交《结题报告》及相关附件和受理文件及签收单,如有中心关闭函和/或分中心小结,请一并递交。
u 以上所涉及的表格在我院内网OA主页---伦理委员会办公室---相关表格下载栏均有下载。
u 如研究项目负责人逾期一个月仍未按审查决议规定向伦理审查委员会递交跟踪审查的相关材料,委员会可以终止其研究/试验的继续进行。重启已被终止的研究/试验方案,需要向审查委员会重新递交方案申请。
u 如有问题请及时联系,伦理办公室电话64923400—4298.
申请人签名: 日期:


